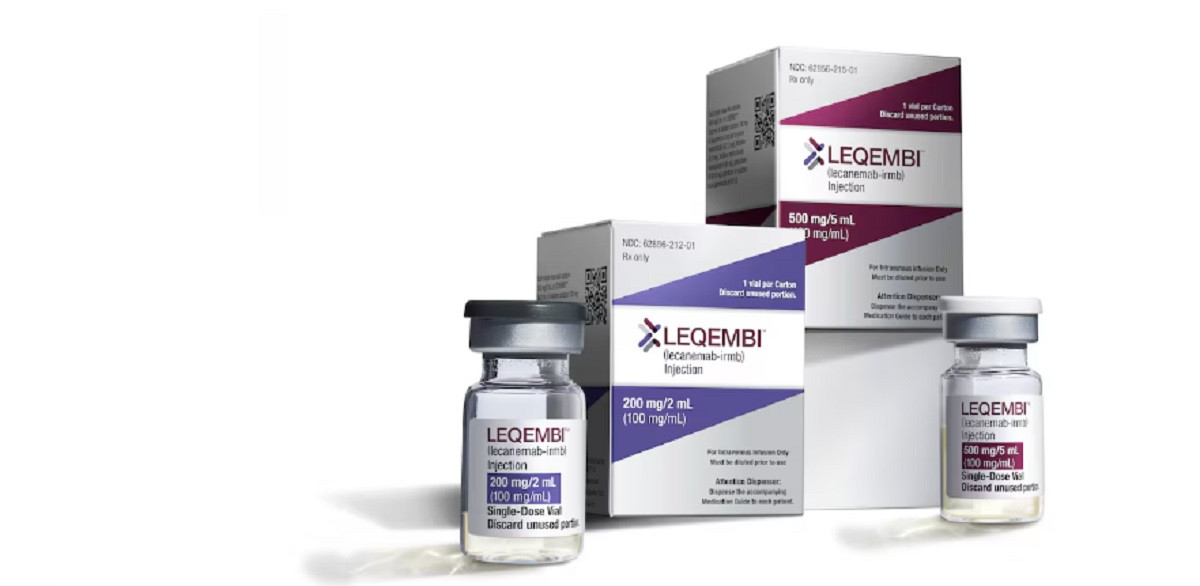
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων δεν ενέκρινε την κυκλοφορία του φαρμάκου για το Αλτσχάιμερ, Leqembi, όπως μεταδίδει το Reuters. Το συγκεκριμένο φάρμακο παρασκευάστηκε από τις εταιρείες Eisai και Biogen.
Η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση του Οργανισμού είχε συστήσει τη μη χορήγηση άδειας, καθώς τα παρατηρούμενα οφέλη δεν αντιστάθμισαν τον κίνδυνο σοβαρών ανεπιθύμητων παρενεργειών, ιδιαίτερα εγκεφαλικού οιδήματος και αιμορραγίας ή μικροαιμορραγιών.
Σε κλινικές δοκιμές, το φάρμακο επιβράδυνε τη γνωστική έκπτωση κατά 27% σε ασθενείς με Αλτσχάιμερ σε πρώιμο στάδιο, σε σύγκριση με ένα εικονικό φάρμακο.
«Η σοβαρότητα των παρενεργειών θα πρέπει να ληφθεί υπόψιν στο πλαίσιο της μικρής επίδρασης που παρατηρείται με το φάρμακο», είπε η ρυθμιστική αρχή.
Η Biogen και η Eisai δεν απάντησαν αμέσως στα αιτήματα του Reuters για σχολιασμό. Οι μετοχές της Biogen υποχώρησαν 5,5% στα 215 δολάρια στις προκαταρκτικές συναλλαγές στις ΗΠΑ.
Η σύσταση πρέπει να υποστηριχθεί επίσημα από την Ευρωπαϊκή Επιτροπή, η οποία συνήθως ακολουθεί αυτόματα την απόφαση της ρυθμιστικής αρχής.
Στην Ευρώπη, επτά εκατομμύρια άνθρωποι ζουν με την ασθένεια, και ο αριθμός αυτός αναμένεται να διπλασιαστεί μέχρι το 2050, σύμφωνα με την Alzheimer's Europe, έναν μη κερδοσκοπικό οργανισμό.
Το συγκεκριμένο φάρμακο, το lecanemab, πωλείται ως Leqembi στις ΗΠΑ και επρόκειτο να είναι το πρώτο φάρμακο στην Ευρώπη για τη θεραπεία της νευροεκφυλιστικής πάθησης.
Το λανσάρισμα του Leqembi στις ΗΠΑ ήταν μέχρι στιγμής αδύναμο, λόγω απαιτήσεων όπως πρόσθετες διαγνωστικές εξετάσεις, εγχύσεις δύο φορές το μήνα και τακτικές σαρώσεις εγκεφάλου.
Ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ ενέκρινε στις 2 Ιουλίου το φάρμακο της Eli Lilly για το Alzheimer, Kisunla. Σε αντίθεση με το Leqembi, το Kinsula απαιτεί μία δόση, η οποία επιτρέπει στους ασθενείς να σταματήσουν τη θεραπεία όταν οι σαρώσεις εγκεφάλου δεν δείχνουν πλέον αμυλοειδείς πλάκες.