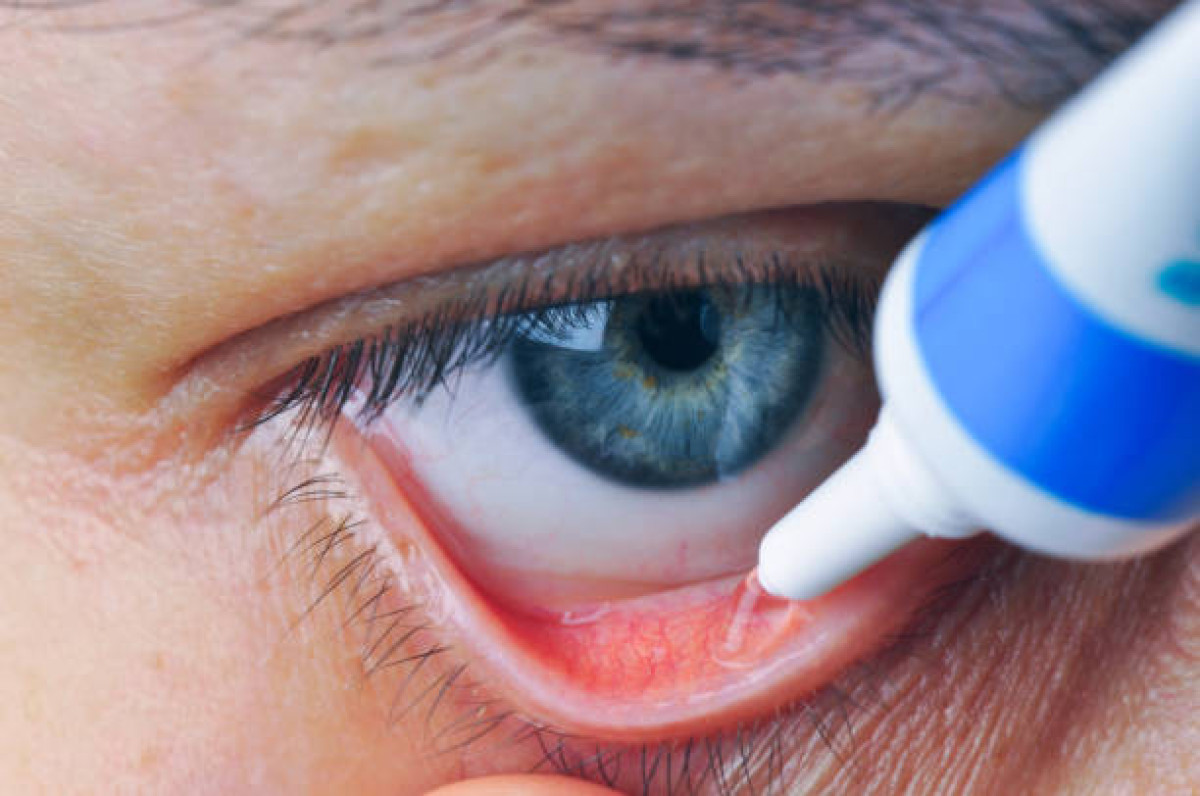
Τέσσερα λιπαντικά για τα μάτια, έχουν προστεθεί στον αυξανόμενο κατάλογο των δυνητικά μολυσμένων μη συνταγογραφούμενων προϊόντων για τα μάτια που κατασκευάζονται στην Ινδία. Ο FDA δημοσίευσε την ανακοίνωση ανάκλησης στην ιστοσελίδα του και η ανάκληση αφορά συγκεκριμένα:
Equate Lubricant Eye Ointment με αριθμό UPC 681131395298 και αριθμούς παρτίδας A2E0, A2L05, A3B01, A3C01 και A3H05.
Equate Stye Lubricant Eye Ointment με αριθμό UPC 681131395304 και αριθμούς παρτίδας A2D08, A2F02, A2I03, A2L03, A2L04, A3C03, A3C05, A3H01 και A3H03
Λιπαντική οφθαλμική αλοιφή CVS Health με αριθμό UPC 050428634141 και αριθμούς παρτίδας A2F03, A2I02, A2L02, A3C04 και A3H04
AACE Pharmaceuticals Λιπαντική αλοιφή PM με αριθμό UPC 371406124356 και αριθμούς παρτίδας A2G01, A2G02, A3F08, A3F09, A3J17 και A3J18
Οι ημερομηνίες λήξης των επηρεαζόμενων σωληναρίων κυμαίνονται από τον Μάρτιο του 2024 έως τον Σεπτέμβριο του 2025. Τα προϊόντα ανακλήθηκαν μετά από επιθεώρηση από τις ρυθμιστικές αρχές των ΗΠΑ, οι οποίες διαπίστωσαν προβλήματα στειρότητας εκεί όπου παρασκευάζονται οι οφθαλμικές αλοιφές.
Η Brassica Pharma Pvt. Ltd. με έδρα την Ινδία ανέφερε ότι δεν είχε λάβει καμία αναφορά για ανεπιθύμητα συμβάντα που να σχετίζονται με τις αλοιφές από τις 16 Φεβρουαρίου.
«Για τους ασθενείς που χρησιμοποιούν αυτά τα προϊόντα, υπάρχει πιθανός κίνδυνος οφθαλμικών λοιμώξεων ή συναφών βλαβών. Τα οφθαλμικά φαρμακευτικά προϊόντα ενέχουν δυνητικά αυξημένο κίνδυνο βλάβης για τους χρήστες, επειδή τα φάρμακα που εφαρμόζονται στα μάτια παρακάμπτουν ορισμένες από τις φυσικές άμυνες του οργανισμού», αναφέρεται στην ανακοίνωση ανάκλησης της εταιρείας που αναρτήθηκε στην ιστοσελίδα ανάκλησης του FDA.
Κίνδυνος μόλυνσης για τα μάτια
Πρόκειται για την τελευταία σε μια σειρά ανακλήσεων που αφορούν περισσότερα από δύο δωδεκάδες προϊόντα για τα μάτια λόγω κινδύνων μόλυνσης. Πέρυσι, οι αξιωματούχοι προειδοποίησαν επειγόντως τους ανθρώπους να σταματήσουν να χρησιμοποιούν τα τεχνητά δάκρυα EzriCare, τα τεχνητά δάκρυα της Delsam Pharma και την τεχνητή αλοιφή της Delsam Pharma, τα οποία όλα κατασκευάστηκαν από τον ίδιο κατασκευαστή. Τα προϊόντα συνδέθηκαν με βακτηριακές λοιμώξεις που επηρέασαν 81 άτομα σε 18 πολιτείες. Ορισμένα από τα επηρεαζόμενα άτομα ζούσαν σε εγκαταστάσεις μακροχρόνιας φροντίδας. Οι λοιμώξεις συνδέθηκαν με απώλεια της όρασης σε 14 άτομα και με την ανάγκη χειρουργικής αφαίρεσης του βολβού του ματιού σε τέσσερα άτομα.
Για αυτή την τελευταία ανάκληση, οι καταναλωτές που έχουν το προϊόν μπορούν να επιστρέψουν το προϊόν από όπου το αγόρασαν και μπορούν να επικοινωνήσουν με την Brassica Pharma Pvt. Ltd. για τυχόν ερωτήσεις στο 833-225-9564 ή στο Αυτή η διεύθυνση ηλεκτρονικού ταχυδρομείου προστατεύεται από τους αυτοματισμούς αποστολέων ανεπιθύμητων μηνυμάτων. Χρειάζεται να ενεργοποιήσετε τη JavaScript για να μπορέσετε να τη δείτε. .
Τα άτομα που αντιμετώπισαν προβλήματα που μπορεί να σχετίζονται με τη χρήση των οφθαλμικών αλοιφών θα πρέπει να επικοινωνήσουν με τον πάροχο υγείας τους και οι κακές αντιδράσεις θα πρέπει να αναφερθούν στο πρόγραμμα αναφοράς ανεπιθύμητων ενεργειών MedWatch του FDA.