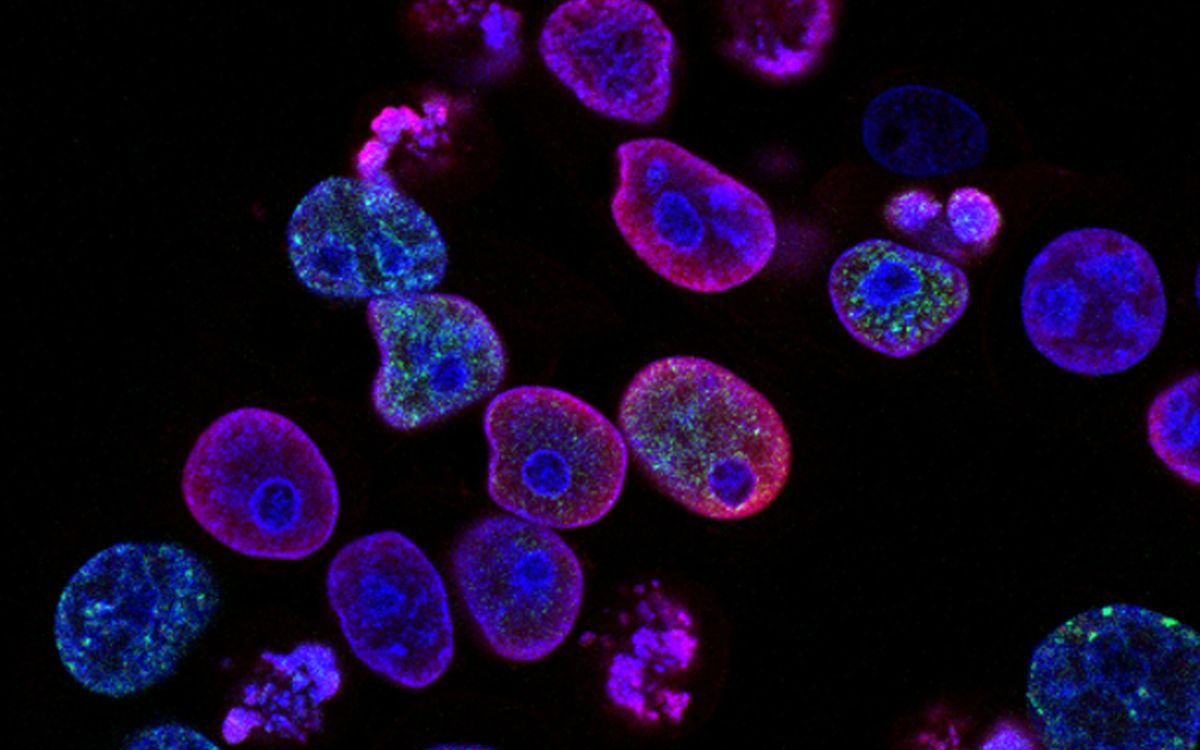
Αποτελούν μια από τις μεγάλες ιατρικές ανακαλύψεις της τελευταίας δεκαετίας, επαναστατικές θεραπείες που είναι σε θέση να ξεπεράσουν διάφορους καρκίνους του αίματος που είναι ανθεκτικοί στις συμβατικές χημειοθεραπείες σε έως και τους μισούς ασθενείς.
Όμως οι CAR-Ts, οι οποίες περιλαμβάνουν τον επαναπρογραμματισμό των Τ-κυττάρων του ανοσοποιητικού συστήματος στο εργαστήριο για να τους διδάξουν να επιτίθενται στα καρκινικά, κυκλοφορούν στην αγορά για τόσο σύντομο χρονικό διάστημα - τα πρώτα εγκρίθηκαν το 2017 - που υπάρχουν ακόμη πολλά ερωτήματα που πρέπει να απαντηθούν σχετικά με τις μακροπρόθεσμες επιπτώσεις και την ασφάλειά τους.
Αυτός είναι ο λόγος για τον οποίο η δημοσίευση στις 28 Νοεμβρίου μιας ανακοίνωσης της αμερικανικής υπηρεσίας φαρμάκων, του FDA, που ενημερώνει ότι διερευνά «τον σοβαρό κίνδυνο» ότι τα ίδια αυτά κύτταρα θα μπορούσαν να προκαλέσουν έναν άλλο τύπο καρκίνου, αφού εντοπίστηκαν αρκετά κρούσματα -το σημείωμα δεν διευκρινίζει τον αριθμό- που εξαπλώθηκαν σαν πυρκαγιά σε νοσοκομεία και ερευνητικά κέντρα.
«Ήταν ένας γνωστός κίνδυνος, αλλά μέχρι τώρα δεν είχαμε ακούσει να συμβαίνει. Οι πιθανότητες να συμβεί αυτό είναι πολύ μικρές, αν σκεφτεί κανείς ότι υπάρχουν ήδη δεκάδες χιλιάδες ασθενείς σε όλο τον κόσμο που έχουν ήδη υποβληθεί σε θεραπεία με CAR-T. Είναι όμως ένας σημαντικός κίνδυνος που πρέπει να διερευνηθεί, επειδή γνωρίζουμε ακόμη πολύ λίγα γι' αυτόν», λέει ο Javier Briones, επικεφαλής της Immune Research.
«Αλλά είναι ένας σημαντικός κίνδυνος που πρέπει να διερευνηθεί επειδή γνωρίζουμε ακόμη πολύ λίγα γι' αυτόν», λέει ο Javier Briones, επικεφαλής της Έρευνας στην κυτταρική ανοσοθεραπεία και τη γονιδιακή θεραπεία στο Sant Pau της Βαρκελώνης, ο οποίος ηγείται της ανάπτυξης του πρώτου CAR-T που είναι αποτελεσματικό κατά του λεμφώματος Hodgkin στο κέντρο.
Η είδηση συγκλόνισε επίσης τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA), ο οποίος επικοινώνησε με τον FDA για περισσότερες λεπτομέρειες. «Είμαστε ενήμεροι για αναφορές δευτερογενών κακοηθειών με ορισμένα φάρμακα CAR T-κυττάρων. Έχουμε έρθει σε επαφή με τον FDA για να συγκεντρώσουμε περισσότερες πληροφορίες σχετικά με τις περιπτώσεις που αναφέρθηκαν στις αμερικανικές αρχές», έγραψε εκπρόσωπος σε ανακοίνωσή του.
Ο EMA και ο FDA έχουν εγκρίνει έξι θεραπείες CAR-T κατά διαφόρων τύπων λευχαιμίας, λεμφώματος και μυελώματος από το 2017, αν και υπάρχουν πολλές ακόμη υπό ανάπτυξη. Πρόκειται για τις Kymriah (Novartis), Yescarta και Tecartus (Gilead), Abecma και Breyanzi (Bristol Myers Squibb) και Carvykti (Johnson & Johnson θυγατρική Janssen) και όλες έχουν συμπεριληφθεί στην ανακοίνωση του αμερικανικού οργανισμού, η οποία παρά τον μεγάλο ενθουσιασμό που προκάλεσε, άφησε επίσης πολλούς ερευνητές απογοητευμένους. «Η δήλωση αναφέρει μόνο ότι ορισμένοι ασθενείς ανέπτυξαν Τ-λέμφωμα μετά τη χορήγηση CAR-T, αλλά τίποτα περισσότερο. Δεν λέει πόσοι ήταν ή με ποια θεραπεία..... Περιμένουμε όλοι περισσότερες λεπτομέρειες», παραδέχεται ο Briones.
Το σημείωμα του FDA αναφέρει πάντως ότι τα περιστατικά εντοπίστηκαν κατά τη διάρκεια «της φάσης των κλινικών δοκιμών ή/και των πηγών δεδομένων ανεπιθύμητων ενεργειών (ΑΕ) μετά την κυκλοφορία» και σε «αρκετά προϊόντα της κατηγορίας», γεγονός που τον οδήγησε να διαπιστώσει ότι «ο κίνδυνος κακοήθειας των Τ-κυττάρων ισχύει για όλες τις εγκεκριμένες επί του παρόντος γενετικά τροποποιημένες αυτολογικού τύπου ανοσοθεραπείες CAR Τ-κυττάρων με κατεύθυνση BCMA και CD19».
Ο ΕΜΑ, από την πλευρά του, υπενθυμίζει ότι η ΕΕ έχει ήδη θεωρήσει «τις δευτερογενείς κακοήθειες, συμπεριλαμβανομένων των κακοηθειών των Τ-κυττάρων, ως σημαντικό δυνητικό κίνδυνο» αυτών των θεραπειών και ότι ως τέτοιος περιλαμβάνεται στα αντίστοιχα δελτία δεδομένων. Επιπλέον, προσθέτει ο οργανισμός, όλοι οι ασθενείς που τις λαμβάνουν παρακολουθούνται στενά για πιθανές ανεπιθύμητες ενέργειες: «Όλα τα φάρμακα CAR-T-κυττάρων παρακολουθούνται στενά και μέσω μελετών ασφάλειας μετά την έγκριση».